医療機器申請の概要
中国医療機器分類
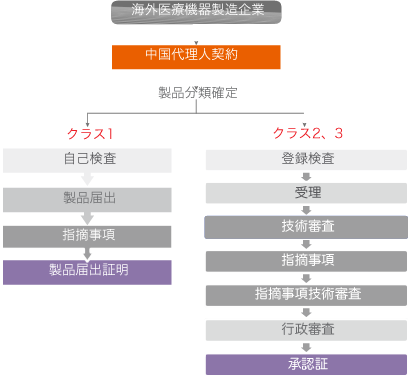
中国へ医療機器を輸出する際、医療機器登録証書を取得しないと販売できない。中国では医療機器リスクに応じてクラス1から3に分類、管理する。国家食品薬品監督管理総局(CFDA)は医療機器の監督管理現状に合わせ、不定期的に「医療機器分類目録」を更新しクラス分類を調整している。
CFDAは2014年7月30日に「医療機器登録管理方法」(CFDA第4号令)を発表し、その同時に旧局令16号を廃止した。新「医療機器登録管理方法」(に基づき、クラス1医療機器は登録申請から届出管理に変わり、クラス2、3の医療機器は登録管理をされる。クラス分類により許可手順及び要求が異なりますので、医療機器を登録申請する前に、製品分類の確定は極めて重要である。
医療機器の分類確定は製品の予期用途、構造特徴及び使用方法を考慮しなければならない。医療機器分類規則、分類目録、標準により確定する。
![]()
中国薬事申請
範囲:(医療機器のクラス1〜クラス3)届出、新規申請、登録変更、延長申請。
輸入医療機器の登録申請(届出)流れ:
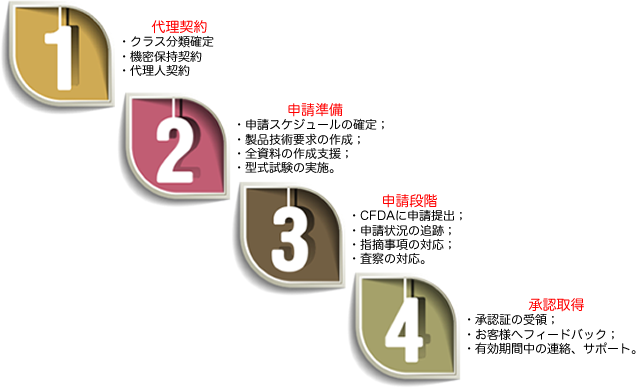
*注:指摘事項がある場合、その時間は審査時間にカウントされません。
新橋科学医療機器申請のサービス
・ クラス分類の確定
・ 申請スケジュール作成、申請資料リストの提供
・ 製品技術要求の作成、そのた資料作成サポート、確認
・ 医療機器登録検査の実施(クラス2、3)
・ 医療機器臨床試験(適応の場合)
・ CFDAに申請提出
・ 申請状況の追跡、指摘事項の対応
・ CFDA査察の対応
・ 承認証の取得及びお客様へのフィードバック
![]()
医療機器登録検査
登録検査はCFDA認可された検査機構において、技術要求に基づき製品サンプルの機能性と安全性、及び製品添付文書、ラベルに対し確認検査するプロセスである。
クラス2、3の医療機器は申請する前に、検査機構で検査を依頼し、検査報告を取得する。そしてCFDAへの申請資料の一つとして提出しなければならない。クラス1の医療機器は、届出する時、企業の自己検査報告或は第三方検査報告を提出すること。
新橋科学のサービス:
・ 検査計画の作成、検査項目の確定及び検査免除可能項目の申請
・ 検査機関の選択
・ 検査機間と連絡し、検査スケジュール、検査資料・サンプルの確定
・ 技術要求の作成
・ 検査資料の提出、サンプル調達、
・ 検査のフォロー、検査官と交流、随時に申請者にフィードバックする
![]()
中国医療機器申請委託の流れ
新橋科学へ業務委託の利点
・実績:日本医療機器製造企業の40以上製品を承認取得した。成功率100%。
・便利:日本に本社を設置しており、随時、打ち合わせできる。担当者の負担は大幅削減。
・経験:臨床診療経験、製品開発経験、薬事申請経験、臨床開発経験者により構成した申請チーム。
・安心:中国医療機器法規制の収集、分析体制は完備で、様々な企業問題を解決した経験を用い、効率かつ低コストで申請サービスを提供。
![]()
![]()